Способы промышленного производства
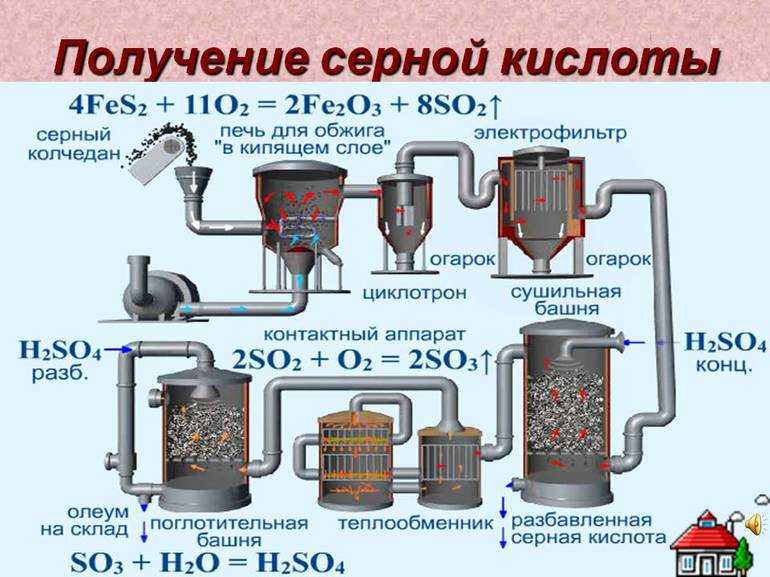
В качестве сырья долгое время использовался природный минерал пирит — «серный колчедан». Сегодня ему на смену пришли элементарная сера или её соединения: сероводород, соли — сульфиты и сульфаты, а также газовые отходы теплоэлектростанций, работающих на неочищенной нефти. Производство имеет ряд последовательных стадий:
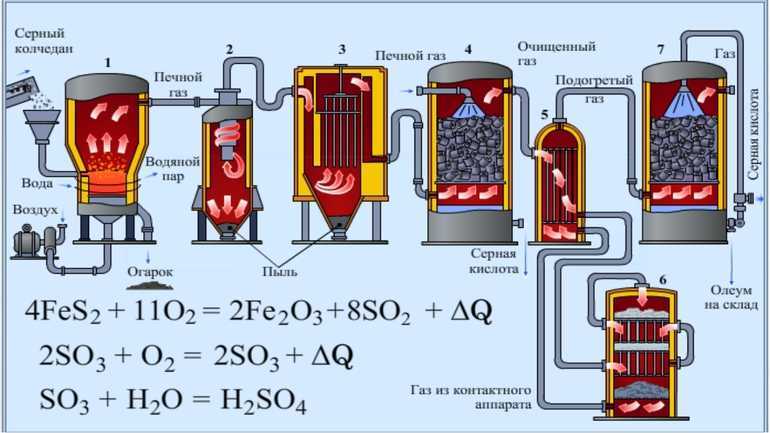
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
«Едва ли найдётся другое, искусственно добываемое вещество, столь часто применяемое в технике» — эти слова гениального русского учёного Д. И. Менделеева наглядно характеризуют ценность серной кислоты. Сегодня при её производстве используются две методики окисления диоксида серы:
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.

Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Индикатор | Нейтральная среда | Кислая среда |
|---|---|---|
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Факты и мифы о лимонной кислоте
Из-за низкой токсичности и широкого применения в различных сферах о лимонной кислоте существует немало мифов. Наиболее распространенными являются следующие:
- Добавка Е330 замедляет развитие раковых опухолей. Регулярное потребление овощей и фруктов (в частности лимонов) снижает риск развития злокачественных новообразований. Однако противораковое воздействие цитрусов связано с наличием в их составе антиоксидантов флавонов, а не органических кислот.
- Кислота и соли-цитраты являются сильными канцерогенами. В 1976 г. неизвестными авторами был опубликован Вильжюифский список — перечень якобы опасных добавок, которые были допущены к применению в пищевой промышленности. Наиболее токсичным канцерогеном в нем признавалась лимонная кислота. Факты, изложенные в этом документе, были опровергнуты многочисленными исследованиями.
- Е330 стимулирует иммунитет. Этот миф обусловлен тем, что многие потребители путают лимонную и аскорбиновую кислоту. Лимоны и другие цитрусовые содержат оба этих вещества, однако в работе иммунной системы принимает участие только витамин С.
- Кислота помогает похудеть. Напитки на основе лимонного сока и кислоты рекомендуют пить при большом количестве лишнего веса. Однако на практике наиболее полезным для худеющих является свежий лимон, поскольку он содержит комплекс витаминов, минеральных солей и пектина. Последний снижает аппетит и улучшает работу ЖКТ.
- Е330 купирует хронические воспаления. Повышенную кислотность организма ассоциируют с развитием метаболических нарушений, онкологических заболеваний и воспалительных процессов. Лимон относится к щелочным продуктам, поскольку при его переваривании образуется большое количество минеральных солей. Нормализация электролитного баланса помогает компенсировать последствия избыточного употребления мяса, сахара и рафинированной пищи. Однако кислота не обладает этими полезными свойствами, поскольку не содержит солей микроэлементов.
Вопросы, вопросы
По счастью, после опубликования данных FDA ряд производителей газировки и соков изменили составы, чтобы убрать или минимизировать присутствие бензола. Основное напряжение было снято. Обозначены предельно допустимые значения бензола, общественность, казалось бы, успокоилась. Консервант продолжил широко использоваться как в пищевой, так и в косметической промышленности. И здесь закономерным образом возникает вопрос: как относиться к тому, что бензоант натрия встречается в косметических средствах вместе с витамином С. Для любителей натуральной косметики тема особенно актуальна, потому что производители, уходя от парабенов, консервируют свои составы пищевыми консервантами, среди которых бензоат натрия один из самых популярных.
На авторитетных косметических ресурсах, которые я читаю, однозначно рекомендуют отказываться от средств, где в составах присутствуют бензоат натрия и витамин С. Однако я решила капнуть немного глубже, чтобы убедиться в том, есть ли проблема на самом деле или только ее видимость. Я пришла к выводу, что разобраться полностью не представляется возможным. Во-первых, содержание этого противоречивого консерванта в косметическом средстве может быть ничтожно мало, чтобы формировать бензол. Во-вторых, немаловажным фактором является pH средства. Чем выше pH состава, тем меньше шансов, что в результате реакции образуется бензол. В-третьих, при стабильной форме витамина С реакции может и не быть.
Успокоиться, правда, тоже не получается. Чтобы быть эффективными, средства с витамином С должны иметь низкий pH (3.5 и ниже), то есть более благоприятный кислотно-щелочной уровень для образования бензола. Воздух, температура и свет также могут помогать нежелательной реакции. Далеко не вся косметика идет в темных упаковках без доступа воздуха. Бюджетные марки обычно предпочитают пластиковые тубы либо открытые баночки. Есть специалисты, которые считают, что бензоат натрия вообще нужно избегать категорически как в косметике, так и в пище. По их мнению, если человек употребляет в пищу витамин С или этот витамин уже присутствует в организме, то использование/поедание любого продукта с бензоатом натрия (или калия) будет формировать бензол.
Характеристики бензойной кислоты
Бензойная кислота – это химическое соединение, представляющее из себя одноосновную простейшую карбоновую кислоту ароматического ряда. Она представляет из себя белое вещество, состоящее из кристаллических гранул, которые, по своему виду, напоминает длинные отражающие свет кристаллы в виде тонких листочков.
Эта кислота считается слабой, ее кристаллы легко растворяются в любой жидкой среде: в воде, в спирте, в жире. При нагревании бензойная кислота может переходить в газообразное состояние. Температура ее нагревания составляет 122 градуса.
Она была произведена в XVI веке из бензойной смолы (другое название росный ладан – быстро застывающая смола некоторых деревьев с приятным ярко выраженным запахом ванилина), от имени которого и была названа. Полученные из бензойной кислоты бензоаты (это соли и эфиры бензойной кислоты) зарегистрированы как консерванты (Е210, Е211, Е212, Е213).
Эти вещества легко производятся и имеют доступную стоимость производства. Основное используемое в качестве консерванта свойство – это снижение активности некоторых возбудителей – бактерий, грибов.
Бензойная кислота действует на микроорганизмы замедляя обмен веществ в клетках, блокируя ферменты, которые участвуют в поддержании жизнедеятельности этих возбудителей.
Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Средства для волос
Использование производителями benzoic acid в косметике для волос должно сопровождаться указанием мер предосторожности. Если при мытье головы шампунем на кожу попадает ничтожно малое количество Е210, то при создании прически вдыхается критическое ее количество с парами лака для волос
Аэрозольные смеси имеют маленькую каплю, вследствие чего долго находятся во взвешенном состоянии. Характерный запах парикмахерской во многом обусловлен средствами для укладки. При несоблюдении правил использования и количества лака, распыленного на волосы, раздражаются дыхательные пути, что при постоянном воздействии может привести к аллергической астме.
Возгонка
Реактив легко поддаётся возгонке. При этом кристаллы сублимируются из паров, минуя жидкую фазу. Такой переход легко проследить при помощи опыта «зима в стакане» или «искусственный снег». Для этого в термостойкую химическую посуду помещают небольшое количество реагента и еловую веточку. Сверху располагают круглодонную колбу с водой, она послужит холодильником и крышкой. Конструкцию устанавливают на штатив и подвергают нагреванию. При этом реактив начинает возгоняться. Пары, достигая колбы с холодной водой, кристаллизуются и превращаются в «снег». Они оседают на еловой ветке и стенках стакана в виде тоненьких иголочек. Потрясающее зрелище! У него есть и практическое применение – сублимацию используют для получения и бензойной кислоты.
Польза и вред
Получить пользу для организма, съев какой-то продукт, содержащий консервант E 211, —нереально. Можно лишь говорить о пользе вещества бензоата натрия, использующегося в медицине для приготовления сиропа от кашля.
Что касается вреда, то здесь здесь можно было бы вспомнить Альберта Эйнштейна с его знаменитой теорией, ведь воздействие E 211 на организм человека зависит от многих «если»:

При определенных условиях (температурный режим, освещение) в результате реакции Е 211 и аскорбиновой кислоты образуется ракообразующее вещество бензол.
Авторитетный в среде молекулярных биологов профессор П
Пайпер, проведя изучение воздействия бензоата натрия на митохондрии клеток, пришел к выводу о том, что мутации митохондрий, вызванные этим веществом, могут являться одной из причин болезни Паркинсона.
Длительные исследования воздействия Е 211 на крыс не показали сколько-нибудь серьезных негативных изменений в их организмах, но не стоит забывать, что сроки жизни крысы и человека разнятся, а если принять во внимание мутагенность вещества, то перспективы воздействия Е 211 на здоровье человека не должны казаться радужными.. Если же говорить о доказанном вреде консерванта E 211, то зарегистрированные случаи негативного воздействия натрия бензоата чаще всего проявляются как:
Если же говорить о доказанном вреде консерванта E 211, то зарегистрированные случаи негативного воздействия натрия бензоата чаще всего проявляются как:
- крапивница;
- обострение симптомов у астматиков;
- аллергические реакции.
Поэтому если вы хотите быть здоровым, то старайтесь избегать использования синтетических консервантам, а отдавайте предпочтение натуральным добавкам, как например, Е200 (сорбиновая кислота).
Формула и физические свойства
Одно из основных соединений в промышленности — серная кислота — имеет химическую формулу H2SO4. Её молекула состоит из четырёх атомов кислорода, двух — водорода и одного — серы. Эта токсичная плотная маслянистая жидкость без запаха в очищенном состоянии не имеет цвета и обладает характерным «медным» привкусом. Плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают неочищенному продукту желтоватую или буро-жёлтую окраску.

Соединение кипит при +296 °C, плавится при температуре +10,3 °C. Его кристаллы гигроскопичны и активно отнимают воду у всего окружающего, обугливают бумагу, древесину, сахар. Теплота гидратации при растворении столь велика, что вызывает вскипание смеси и разбрызгивание. Именно поэтому для смешения добавляют кислоту к воде, а не наоборот. Старинное название «купоросное масло» отсылает к XVIII—XIX вв. , когда серу для изготовления пороха получали разложением пирита на купоросных заводах. И до сих пор кристаллогидраты её солей именуются купоросами.
Медикам и строителям давно известен природный гипс — кристаллогидрат сульфата кальция. Садоводы и огородники любят медный купорос — ценный помощник в борьбе с различными вредителями и болезнями растений. Квасцы незаменимы в производстве красок и для дубления кожи. Десятиводный кристаллогидрат сульфата натрия — «глауберова соль» — используется в химической промышленности, деревопереработке и медицине (слабительное и желчегонное средство для людей и животных).
Вред бензоата натрия для здоровья
В конце 1990-х годов была опубликована научная работа известного молекулярного биолога Пайпера о вреде бензоата натрия в составе косметики и пищевых продуктов для человека.
В работе были представлены доказательства о неблагоприятных последствиях употребления бензоата натрия:
- бензоат натрия вызывает мутации в митохондриальной ДНК;
- бензоат натрия вызывает окислительный стресс в клетках желудочно-кишечного тракта;
- бензоат натрия вызывает отдаленные последствия для здоровья, такие как болезнь Паркинсона и другие заболевания нервной системы.
Всемирная организация здравоохранения также проводила исследования о воздействии бензоата натрия на организм животных и человека.Согласно заключению ВОЗ бензоат натрия в составе косметических средств и продуктов может вызывать побочные явления:
- аллергические реакции;
- обострение симптомов астмы;
- генетические мутации.
Особенно опасен бензоат натрия в продуктах, содержащих витамин С. При взаимодействии бензоата натрия и витамина С образуются высокие концентрации канцерогенного вещества, превышающие разрешенные показатели.
Химические свойства
Химические свойства карбоновых кислот такие же, что и у неорганических,
- Диссоциация в воде. Образуется ион водорода и карбоксилат ион. Наиболее сильной является метановая. Другие соединения имеют среднюю силу. Она уменьшается по мере роста атомов С.
- Реакция с металлами: 2НСООН + → ()2 + 2.
- Реакция с щелочами: → 3 + 2.
- Реакция с основным оксидом: 2НСООН +СаО → ()2 + 2.
- Реакция с солями слабых кислот: 2СН3СН + 23 → 23 + 23. В этом случае образуется натрия ацетат, а 23 выпадает в осадок.
- Реакция с аммиаком: С2Н5СООН + 3 → 254. В этом случае образуется пропионат аммония.
- Взаимодействие со спиртами: СН3СН + С2Н5ОН → СН3СС2Н5 + Н2О.
- Вступают в реакции с галогенами с синтезом хлопроизводных карбоновой кислоты и хлористого водорода. Эта реакция происходит вместе с катализатором — красного фосфора. При окислении хлором НСООН разлагается до углекислого газа и хлористого водорода.
- При воздействии чистого кислорода уксус окисляется до углекислого газа и воды.
Бензоат натрия в косметике
Средства по уходу за лицом и телом, особенно те, которые подвергаются воздействию воды в душе или раковине, имеют высокий риск загрязнения из-за бактерий, дрожжей и спор плесени. Также косметические средства, учитывая наличие в их составе эфирных масел, растительных экстрактов и жиров, без применения консервантов имеют весьма короткий срок хранения.

Натрия бензоат или sodium benzoate в косметике может иметь как хороший так и негативный результат.
Испорченная же продукция вредна для кожи и организма в целом. Натрия бензоат в косметике помогает справиться с проблемой продолжительности ее хранения, ведь на прилавке магазина или на туалетном столике средство по уходу может простоять достаточно длительный период. Даже в состав органических косметических средств входит данная добавка.
Она позволяет продукции из натуральных компонентов храниться столько же, сколько и полностью синтетическим веществам. Добавка на основе бензойной кислоты может быть использована в роли консерванта или же как активный компонент в противогрибковой продукции, косметике для ног, волос и составах для проблемной кожи.
Бензоат натрия в косметике обычно используется в предметах личной гигиены, таких как средства для волос, детские салфетки, зубная паста и жидкость для полоскания ротовой полости. Бензоат натрия в косметических средствах сочетается с сорбатом калия, что увеличивает их консервирующие свойства.
В пенящихся средствах (гелях для душа, пенах для ванн) данный компонент присутствует в меньших количествах, так как снижает образование пены. Широкое применение бензоат натрия нашел и в декоративной косметике, сроки хранения которой достаточно длительные.
Наличие бензоата натрия в продуктах личной гигиены было оценено учеными на уровне опасности 3 по шкале от 0 до 10. Это означает, что общий риск его использования относительно низок.
Не пропустите самую популярную статью рубрики: Модная стрижка на средние волосы. Фото, вид спереди и сзади.
Среди основных полезных косметических свойств бензоата натрия выделяют следующие:
консервирующий эффект – натрия бензоат защищает косметический состав от появления в нем патогенных организмов, вызывающих грибок и плесень;

- противовоспалительное действие;
- антибактериальный эффект, который возникает при сочетании натрия бензоата с молочной кислотой;
- относительно низкая токсичность при влиянии на кожные покровы;
- противогрибковый эффект – действуя как консервант, бензоат натрия способен очистить микрофлору не только в самом косметическом средстве, но и избавить от грибка кожные покровы.
Действие бензоата натрия как активного компонента одинаково эффективно для всех типов кожи и для всех типов волос.
Получение и очистка
Как уже было описано выше, впервые бензойную кислоту выделили из росного ладана. Это природное соединение представляет собой смолу стираксового дерева. Для этого измельчённое сырье прогревали на песчаной бане и собирали сублимирующиеся кристаллы в небольшом ящичке, оклеенном бумагой. Полученный продукт имел приятный аромат из-за присутствия эфирных масел в росном ладане – коричного и ванильного.

Также использовался метод взаимодействия гиппуровой кислоты с соляной при сильном нагревании. Первую получали путём упаривания мочи травоядных, затем очищали кристаллизацией до исчезновения характерного запаха. А как же протекает современный синтез такого вещества как бензойная кислота? Получение её очень дешёво, просто и экологично. Его проводят при помощи промышленного оксидирования метилбензола KMnO4, либо частичным взаимодействием исходного реагента с O2. Очистка сырья основана на физических свойствах реактива — низкой растворимости бензойной кислоты в холодной воде и высокой — в горячей, и называется перекристаллизацией.
косметические свойства, описание, применение в косметике
Традиционное название
Латинское название
Название по INCI
БЕНЗИЛБЕНЗОАТ
Растворитель (солюбелизатор)
Активы
Фиксаторы аромата
Антимикробные агенты
Общая опасность6
Канцерогенность0
Опасность при беременности0
Алергенность, Иммунотоксичность4
Ограничение в использовании7
BENYLATE
BENZOIC ACID, BENZYL ESTER
BENZOIC ACID, PHENYLMETHYL ESTER
BENZYL ESTER BENZOIC ACID
PHENYLMETHYL BENZOATE
PHENYLMETHYL ESTER BENZOIC ACID
ASCABIN
ASCABIOL
BENYLATE
BENZOIC ACID, PHENYLMETHYL ESTER
BENZYL ALCOHOL BENZOIC ESTER
Является веществом, способным вызвать аллергические реакции. Не следует постоянно применять средства, содержащие данный компонент.
Бесцветная маслянистая жидкость с легким цветочным запахом. Содержится в некоторых эфирных маслах, в толуанстком и перуансокм бальзамах. В парфюмерии применяется как растворитель, фиксатор и пластификатор в составе лаков для ногтей. В соответствии с законодательством ЕС 1223/2009 и ТР ТС 009/2011 наличие данного компонента в составе парфюмерного продукта обязательно должно быть указано на этикетке косметического или парфюмерного изделия,если его концентрация превышает 0.001% в несмываемых и 0.01% в смываемых продуктах. Бензилбензоат входит в перечень жизненно необходимых и важнейших лекарственных препаратов. Применяется при чесотке, педикулезе, красных угрях и демодекозе, отрубевидном лишае, жирной себореи.Fragrance Ingredient; Solvent; ANTIMICROBIAL; MASKING
Свойства

Кристаллы лимонной кислоты под микроскопом между скрещённых поляроидов. Увеличение 200x.
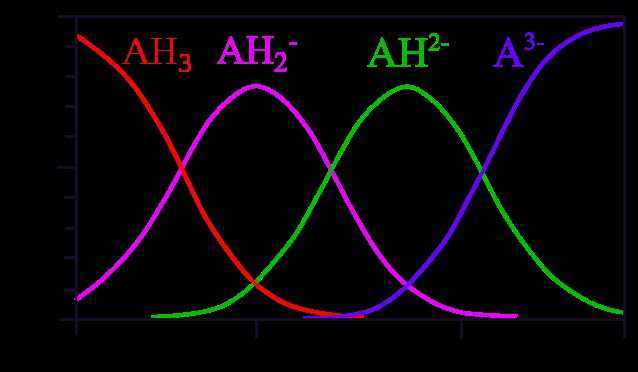
Концентрация ионов при электролитической диссоциации водных растворов лимонной кислоты при разных pH. A — остаток молекулы кислоты. AH3 — недиссоциированная молекула;AH2— — однозарядный ион;AH2— — двухзарядный ион;A3- — трёхзарядный ион.
Является слабой трёхосновной кислотой, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации (в воде при 18 °C):
K1 = 7,447⋅10−4 K2 = 1,7⋅10−5 K3 = 4⋅10−7
Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C, а также при действии сильных кислот лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке, теряя воду и углекислый газ и при одновременном образовании ацетона, даёт ангидриды итаконовой и цитраконовой кислот (см. декарбоксилирование). В реакциях с сильными окислителями (например, перманганат калия, бертолетова соль) переходит в акриловую кислоту и этиленоксид.
В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и другими.
Наиболее популярные природные консерванты
- Neem Oil, масло. Древнейшее и мощнейшее масло, использующееся в Индии. В современной косметике оно выступает в средствах на основе масла в качестве противогрибкового, антибактериального консерванта, а также обладает спермицидным действием.
- Соль, хлорид натрия (sodium chloride). Соль вытягивает влагу, и создает среду, неблагоприятную для бактерий. В косметике используется в очень маленьких количествах, чтобы не раздражать кожу.
- Сахар. Натуральный консервант, ингибирующий рост бактерий. Продукт должен быть нагрет вместе с сахаром.
- Лимон. Лимонная кислота имеет наименование C6H8O7, предотвращает порчу и гниение.
- Мед. Обладает высокой устойчивостью к микробам.
- Прополис. Это смесь пчелиного воска и смол. Имеет антибактериальные и противомикробные свойства.
- Экстракт розмарина. Эффективно против бактерий и грибков.
- Экстракт семян грейпфрута. Природный антибиотик, антисептик, дезинфицирующее средство и консервант. Эффективен против более чем 800 бактериальных и вирусных организмов, 100 штаммов грибов, большого числа одноклеточных или многоклеточных паразитов. Используется в продуктах косметики на водной основе.
- Витамин Е (Альфа-токоферол), антиоксидант, препятствует развитию бактерий.
- Сорбат калия. Сохраняет продукт от плесени и грибка. Не эффективен в продуктах с кислотностью pH более 6, а это большинство лосьонов.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония | Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат | Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия | Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH | Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) | Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |





























